De nouvelles méthodes de synthèse dérivées de l'approche solvothermique, telles que les procédés ionothermiques, ont été utilisées pour obtenir des nanopoudres de LiMPO4 (M= Mn, Co et Ni), LixMSiO4 [Nytén, A. et al. (2005)] et les matériaux de batterie aux fluorophosphates de Li et Na [DiSalvo, FJ et al.
(1971) ; Ellis, BL et coll. (2007b)] en utilisant une basse température de chauffage. La synthèse ionothermique est apparue alors qu'un grand nombre de travaux de recherche visent de nouveaux procédés à faible coût permettant de fabriquer des matériaux d'électrode hautement optimisés sur le plan électrochimique. Cette voie alternative est considérée comme un nouveau procédé de synthèse à faible coût car elle nécessite beaucoup moins d’énergie que les voies céramiques à haute température. Malgré le coût plus élevé des liquides ioniques par rapport à l'eau, il a été prouvé que ces solvants peuvent être réutilisés sans purification lorsqu'ils sont utilisés pour préparer le même matériau, ce qui entraîne une diminution significative des coûts et minimise la production de déchets [Tarascon, JM. et coll. (2010)]. La synthèse ionothermique a également été réalisée avec succès en utilisant des micro-ondes plutôt que le chauffage traditionnel, ce qui réduit le temps de réaction et l'énergie requise pour la synthèse.
La synthèse ionothermique est basée sur l'utilisation d'un liquide ionique comme milieu réactionnel à la place de l'eau dans des conditions solvothermiques. Les liquides ioniques sont une classe de solvants organiques à haute polarité et à structure de solvant préorganisée [Del Popolo, MG et Voth, GA (2004)]. Les liquides ioniques à température ambiante (ou proche de la température ambiante) sont classiquement définis comme des liquides à température ambiante (ou <100 °C) constitués de cations et d'anions organiques.
Ils ont d'excellentes propriétés solvatantes, une faible pression de vapeur mesurable et une stabilité thermique élevée. Les propriétés solvatantes et les températures de fusion dépendront de la combinaison de cations et d'anions choisie. Dans le domaine de la science des matériaux, plusieurs rapports font état d'utilisation de liquides ioniques comme solvants avec des quantités d'eau très faibles ou contrôlées impliquées dans la synthèse [Antonietti, M et al. (2004)]. La plupart de ces études se sont concentrées sur les matériaux amorphes et les nanomatériaux.
Comme l’eau, les liquides ioniques résultant de couples cationiques/anioniques compatibles possèdent d’excellentes propriétés de solvant. De plus, ils possèdent une stabilité thermique élevée et une volatilité négligeable, de sorte que l’utilisation d’un autoclave n’est pas obligatoire. De plus, en raison de la nature flexible des paires cationique/anionique, ils présentent, en tant que solvants, de grandes opportunités pour diriger délibérément la nucléation. Au cours de la dernière décennie, la synthèse ionothermique est devenue une technique de synthèse avantageuse pour la préparation de zéotypes [Lin, ZJ. et coll. (2008)] et d'autres matériaux poreux tels que les composés à structure organométallique (MOF), mais cette technique a été très peu utilisée dans la synthèse de composés inorganiques.
La caractéristique unique de la synthèse ionothermique est que le liquide ionique agit à la fois comme solvant et comme fournisseur de modèle. De nombreux cations liquides ioniques sont chimiquement très similaires à des espèces déjà connues comme de bons modèles (liquides ioniques à base d'alkylimidazolium et de pyridinium). Beaucoup sont des solvants relativement polaires, ce qui les rend adaptés à la dissolution des composants inorganiques nécessaires à la synthèse. L’une des propriétés déterminantes des liquides ioniques est leur absence de pression de vapeur détectable, ce qui entraîne effectivement l’élimination des problèmes de sécurité associés aux pressions hydrothermales élevées et a également conduit à leur utilisation dans la synthèse par micro-ondes.
Dans le processus de voie ionothermique, puisqu'aucun autre solvant n'est ajouté au mélange réactionnel, la théorie soutient qu'aucune autre molécule n'est présente pour agir comme remplisseur d'espace pendant la synthèse. Cela signifie que la méthode ionothermique élimine idéalement la compétition entre les interactions modèle-cadre et solvant-cadre qui sont présentes dans les préparations hydrothermales. Il s’agit cependant d’un scénario idéaliste, qui n’est pas toujours réalisable en raison de la décomposition possible d’une petite fraction des cations liquides ioniques, ce qui entraîne des cations matrices plus petits qui peuvent préférentiellement agir comme agent directeur de la structure dans le solvant liquide ionique [Parnham , ER et Morris, RE (2006)].
Des études récentes de modélisation moléculaire indiquent que les structures des liquides ioniques sont caractérisées par des corrélations et des distributions à longue distance qui reflètent les structures asymétriques des cations. Les effets asymétriques à longue portée de ce type augmentent potentiellement la probabilité de transfert d'informations chimiques du cation modèle au cadre, une situation qui est souhaitable si l'on veut obtenir un contrôle total sur le processus de création de modèles [Parnham, ER et Morris, RE (2007). )].
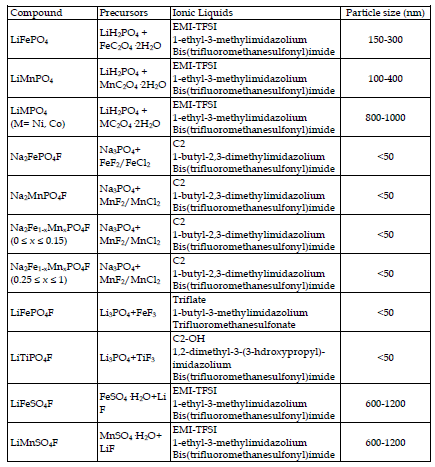
Tarascon et coll. ont été les premiers à appliquer la synthèse ionothermique aux matériaux des électrodes de batterie. Ils ont testé plusieurs liquides ioniques à base de différentes espèces cationiques et anioniques comme milieu réactionnel pour la préparation de la phase LiFePO4 [Recham, N. et al. (2009a)]. Les liquides ioniques utilisés ont démontré avoir un impact sur la nucléation/croissance de LiFePO4 et se comporter comme un agent directeur structurel. Par exemple, l'utilisation d'un liquide ionique EMI-TFSI fonctionnalisé CN [1-éthyl-3-méthylimidazolium bis (trifluorométhanesulfonyl) imide] a produit des poudres en forme d'aiguille dans la direction [010] qui se sont parfaitement empilées pour former une aiguille plus grande. Ce changement sur le groupe terminal a modifié le caractère polaire du milieu réactionnel et ses propriétés solvatantes, influençant ainsi la croissance cristalline. Des particules de type plaquette dans la direction [020] ont été créées en diminuant la polarité via l'utilisation d'un cation EMI à base de C18. La formation de ces
deux types morphologiques peut s'expliquer en termes de surfaces énergétiques concurrentes et est directement liée à la nature du liquide ionique, au pouvoir de solvatation, à la polarité et à l'aptitude à absorber spécifiquement sur l'une des surfaces. En fonction des propriétés du liquide ionique, la minimisation de l'énergie de surface du système se fera via un mécanisme différent. Tous les matériaux produits par LiFePO4 étaient électrochimiquement actifs, mais ceux ayant les meilleures performances étaient de taille 300 et 500 nm, montrant une capacité spécifique de 150 mAh·g-1 à C/10 sans revêtement de carbone.
Le processus ionothermique a été étendu à la synthèse de fluorophosphates à base de Na de taille contrôlée [Na2MPO4F (M = Fe, Mn)] [Recham, N. et al. (2009b)]. Ces phases sont des matériaux d'électrode attrayants car elles sont basées sur des métaux économiques et peuvent être utilisées dans les batteries à base de Li et de Na. De plus, les fluorures possèdent une électronégativité plus élevée, ce qui augmente l'ionicité des liaisons et donc leur potentiel rédox en raison de l'effet inductif. Des échantillons nanométriques de Na2FePO4F et Na2MnPO4F d'environ 25 nm de diamètre ont été préparés dans un liquide ionique de 1,2-diméthyl-3-butylimidazolium bis (trifluorométhanesulfonyl imide), contrairement aux poudres grossières obtenues par méthode céramique. Les performances électrochimiques du composé de fer ont atteint de meilleurs résultats que celles du matériau céramique, avec 115 mAh·g-1, une meilleure capacité initiale, une capacité irréversible plus faible, une polarisation plus faible et une meilleure rétention de capacité. La phase manganèse n'a pas montré d'activité électrochimique, ce qui suit la tendance générale des composés à base de Mn ayant de moins bonnes performances électrochimiques que leur homologue Fe, par exemple dans les familles LiMPO4 et Li2MSiO4. Il y a deux facteurs liés à ce phénomène. Premièrement, la forte distorsion de Jahn-Teller sur Mn3+, qui affecte sa sphère de coordination ; et, deuxièmement, la faible conductivité électronique-ionique des matériaux, en raison de la plus grande ionicité de la liaison MO.
Le processus ionothermique a été utilisé avec succès pour préparer de nouveaux matériaux électroactifs qui n’avaient jamais été obtenus auparavant, tels que LiFeSO4F. Ce matériau possède une structure adéquate pour favoriser la migration des ions Li le long des canaux. Cette phase électroactive n'avait pas été synthétisée auparavant car elle n'est accessible ni par procédé céramique ni en milieu aqueux. Il se décompose à des températures supérieures à 375º C et en milieu aqueux. Ce nouveau matériau cathodique a montré une activité électrochimique à 3,6 V et une capacité spécifique réversible de 140 mAh.g-1, très proche de la valeur de capacité spécifique théorique de 151 mAh.g-1. Ainsi, ce processus préparatoire s’est révélé être un outil utile pour synthétiser des matériaux électroactifs nouveaux et connus de taille nanométrique.
 français
français  English
English français
français Deutsch
Deutsch русский
русский italiano
italiano español
español 日本語
日本語 Polski
Polski svenska
svenska 中文
中文









 IPv6 réseau pris en charge
IPv6 réseau pris en charge